イミダゾールジペプチド(機能性成分食品)|基質と代謝経路
機能性成分イミダゾールジペプチドの基質と代謝経路について解説します。
基質
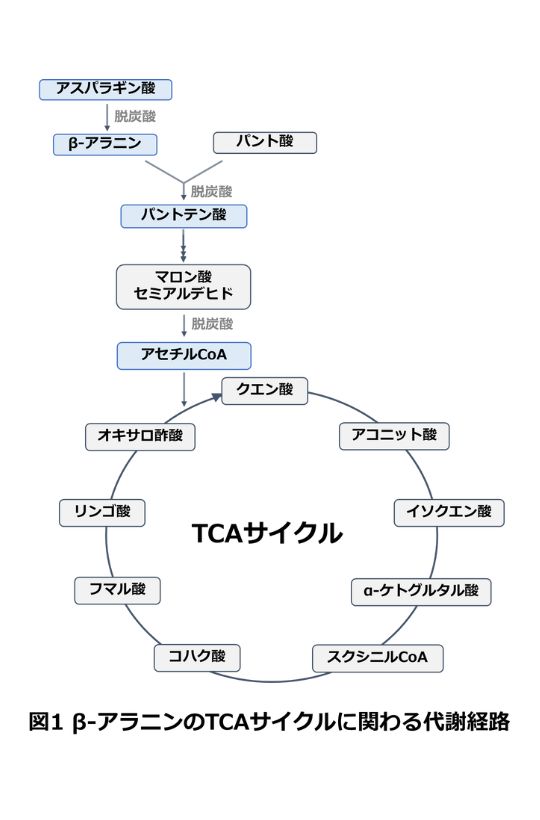
イミダゾールジペプチド(IDP)の基質はβ-アラニン(β-Ala)、ヒスチジン(His) やメチル化ヒスチジンです。β-Alaとは非タンパク質態アミノ酸の一種であり、動物生体内で合成が可能なアミノ酸です。その代謝は主にマロン酸セミアルデヒドとしてTCA サイクルと関係している(図1)ほか、ウラシルからの分解経路の中間体としても代謝されています。生体内においては遊離の状態かIDPの状態、またはパントテン酸やアセチルCoAの構成物質としても存在しています[1]。
Hisはタンパク質を構成するアミノ酸の1つであり、牛、豚、鶏や魚類などの必須アミノ酸です。また、HisにはNπ-methylhistidine(Nπ-MeHis)というメチル誘導体が存在します。カルノシン(Car)はHisとβ-Alaからなり、Ans はNπ-MeHisとβ-AlaからなるIDPです。
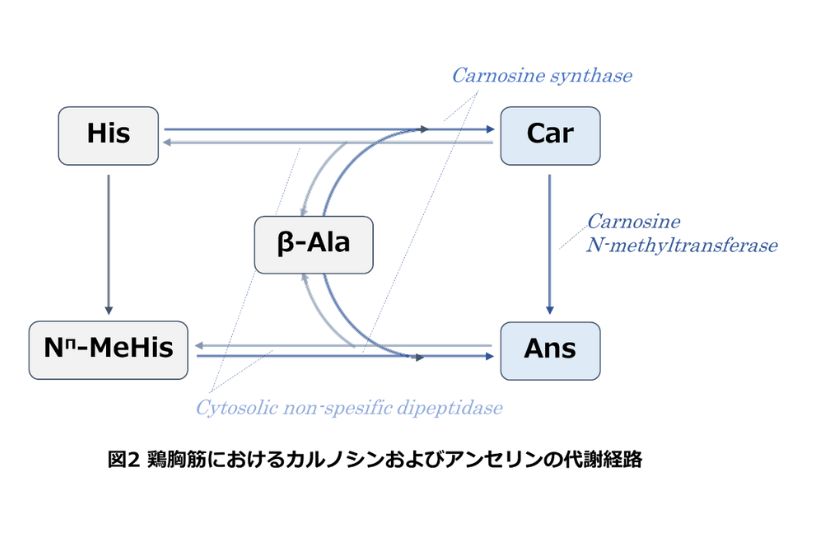
生体内の代謝経路
図2に鶏胸筋におけるCarおよびAnsの代謝経路を示します。Carの生合成はカルノシンシンターゼ(carnosine synthase)によって、基質のHis とβ-Alaから合成されます[2]。Ansの生合成経路は2種あります。1つ目はカルノシン-N-メチルトランスフェラーゼ(carnosine N-methyltransferase)によってCarから合成される経路です。この経路は鶏ヒナの胸筋で確認されています[3], [4], [5]。これはAnsの主要な代謝合成経路と考えられています。しかし、Horinishi et al.,(1978)は、基質特異性(※)の低いカルノシン合成酵素カルノシンシンターゼによってNπ-MeHisとβ-Alaから合成されることを報告しています[6]。
IDPの分解はカルノシナーゼ(carnosinase)によって行われます。このカルノシナーゼはSerum carnosinaseとCytosolic non-spesific dipeptidaseの二つに分けられます。胸筋組織においてはCytosolic non-spesific dipeptidaseが分解酵素として働き、この酵素はIDPに限らず、様々なジペプチドを分解する広い特異性をもつことが示されています[7]。
用語説明
基質特異性:基質とは酵素が働きかけてその反応を触媒する相手物質です。例えば、タンパク質の加水分解反応を触媒する酵素にとって、その基質はタンパク質です。一つの酵素にと ってその基質は多少の幅があるにしろ決って自分の任務以外の基質に関しては一切働きません。これを酵素の基質特異性といいます[8]。
[参考文献]
[1] 甲斐慎一. 2017. 食餌性アミノ酸による筋肉イミダゾールジペプチドの代謝調節に関する研究. 新潟大学大学院博士論文.
[2] Drozak, J., Veiga-da-Cunha, M., Vertommen, D., Stroobant, V., & Van Schaftingen, E. (2010). Molecular identification of carnosine synthase as ATP-grasp domain-containing protein 1 (ATPGD1). Journal of Biological Chemistry, 285, 9346 – 9356.
[3] McManus, R. (1962). Enzymatic synthesis of anserine in skeletal muscle by N-methylation of carnosine. The Journal of Biological Chemistry, 237, 1207 – 1211.
[4] Boldyrev, A. A., & Severin, S. E. (1990). The histidine-containing dipeptides, carnosine and anserine: Distribution, properties and biological significance. Advances in Enzyme Regulation, 30, 175 – 188.
[5] Bauer, K., & Schulz, M. (1994). Biosynthesis of carnosine and related peptides by skeletal muscle cells in primary culture. European Journal of Biochemistry, 219, 43 – 47.
[6] Horinishi, H., Grillo, M., & Margolis, F. L. (1978). Purification and characterization of carnosine synthetase from mouse olfactory bulbs. Journal of Neurochemistry, 31, 909 – 919.
[7] Lenney, J. F., Peppers, S. C., Kucera Orallo, C. M., & George, R. P. (1985). Characterization of human tissue carnosinase. Biochemical Journal, 228, 653 – 660.
[8] 酵素反応の基質特異性
https://www.jstage.jst.go.jp/article/kobunshi1952/20/11/20_11_794/_pdf
